화학1 산,염기 관련된 문제 질문드려요~
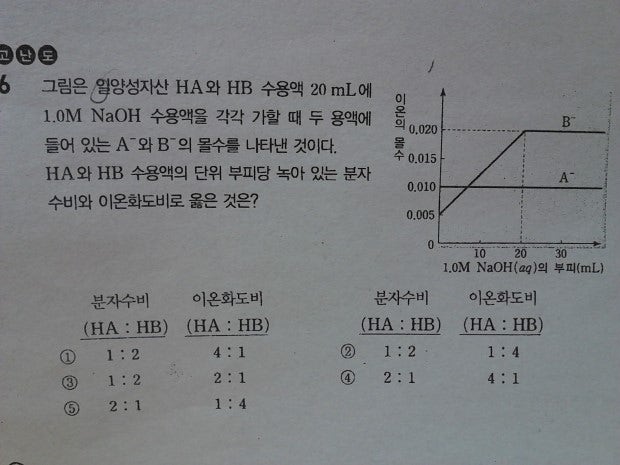


위에 문제 질문드려요~
1. B- 이온수가 NaOH의 넣어준 양과 무슨 관련이 있는거죠? 구경꾼이온은 반응에 참여 안하니까 넣어준 HB 20ml 안에 있는 B- 이온수는 변함이 없을것 같은데 증가하다가 일정하네요..
즉, 답지에선 A-이온이 강산의 짝염기이고, B-이온은 약산의 짝염기라서 위 모양의 그래프가 나왔다는데 강산 혹은 약산의 짝염기라는것과 NaOH를 넣어줌에 따라 A-, B-이온수의 변화와 무슨 관계가 있는지 궁금합니다~
2. 이온화도를 비교하는 부분에서, 이온화도= 이온화된 용질의 몰수/용질의 전체 몰수 아닌가요..?
근데 그래프 상에서 녹아있는 이온수와 전체 이온수에 대한 정보를 어디서 찾을수 있나요?;
0 XDK (+0)
유익한 글을 읽었다면 작성자에게 XDK를 선물하세요.
-
눈먼돈 0
난리네 난리
-
사실임뇨
-
눈이 오더라도 산에 눈 쌓인거만 좀 보는게 끝임 낭만없는 경상도민이라서 울었어
-
선택 관람 나머지
-
98년생 메디컬 도전해봐도 될까요? 의견 부탁드립니다. 0
안녕하세요. 나형 사탐17수능 4353418수능 41212 언매 기하 사탐...
-
이정도면 실채점 나와도 합격하겠죠? 혹시 합격한다면 최초합도 가능한가요?
-
본인 수능전에 재밌게 읽었던거 정치범수용소/북한 인천상륙작전 존 F. 케네디 대통령...
-
바람왤케많이부는거야
-
ㄹㅇ
-
ㅈㄴ 부럽다 인생 진짜 살맛날듯 나는 산만 보이는데 ㅅㅃ이
-
연대 수리 미적/기하 1주일 벼락치기 드간다
-
정시 티오에서 빼오게 되면…. 저 엿되는거죠…????
-
없지 않나
-
이러면 한양대 컷 내려가냐??? 나 냥대 가능성 올라가나??
-
노트북 머사지 8
나 이런거 잘모름뇨
-
대학 다닐때 0
제가 회계학과를 갈려고하는데 대학교 다닐때 노트북이 많이 필요할까요? 이미...
-
공부해야 되는데도 3시간씩 붙잡고 빠져나오질 못했는데 수능 끝나고 나니까 거들떠도 안 봄 ㅋㅋ
-
노출 이런거 빼고 봐도 재밌고 잘 만든 수작입니다
-
님들 그거 앎? 8
쇼미 11 끝난 지 2년 됨 ㅋㅋㅋㅋㅋㅋ
-
이미지메이킹하기 0
만나본사람에동화되서 대충 복사 딸깍
-
오 24렙이다 2
아직은 뉴비
-
내년 연대 공대 편입 고민하고 있었는데 이거 이번 논술 영향 무조건 받겠죠?
-
나랑 전에 사귀던 애는 연봉 1억 씩 받으면서 나보다 더 잘난 사람이랑 사귀고...
-
자신이 좋아하거나 관심있는 사건 관련해서 나무위키 별 얼마나되는지 한번 보셈 은근 재밌음요
-
와이프만나러가기 2
지옥으로
-
개 추워 12
겨울은 이래서 싫다
-
가는 게 맞겠죠? 수학 빼고 전부 지금 발표난 컷에서 1점씩 낮아요… 거의 그럴 일...
-
지금은 라인잡고 모의지원하고 이런게 다 의미가 없는게 1
일단 성적표가 나와야하고 사실 주요 대학들 변표 발표되기 전까진 어느대학을 갈지...
-
나중에 서울간다는 얘기도 있고...어느 말이 맞는지 잘 모르겠네요 찾아봐도 나오지가 않아서..
-
예비고3수학 0
2학년때는 내신 챙기느라 모고 거의 안 풀어봐서 최근에 푼건 없는데 1학년...
-
이렇게 하시는 분들 많나요? 반수아니고 재순데 부모님이 혹시나 재수도 망했을때...
-
1. 영어 노벤데 강의 뭐 들어야 되나요단어 외우세요. 2. X만 보고 Y점수...
-
가군에는 전북대 경영 나군에는 심리학과 이런식으로 가능한가요?
-
실시간 부산.jpg 29
여기는 더워 뒤지겠네
-
눈 못보셨다길래 9
쨘
-
오래되지 않은 생각이다
-
이미지 적어드림 0
응아니야 씹덕들아 이딴걸 왜하노ㅋ
-
해결 완료
-
학교가 거대한 인스티즈같음
-
지방 사람은 뭐하고 놂
-
나도 눈 밟을래 6
아
-
흐흐
-
이쁘다!
-
가보고싶다
-
1컷 50 연속3번 만들고.....당신이 밉다....
-
근데 왤케 적지 나 쌀먹충이야..?
-
ㅎㄷㄷ
-
6모 92 98 2 100 98 9모 95 99 1 95 98 수능 메가: 92...
-
대구도착 14
SRT는빨라요 대구는따뜻하고













































헐 이거 화학1으로 내려왔나요? ㄷㄷ
화학2 내용이었나요? ㅋㅋ;
어쩐지 어렵더라구요 ㅠㅠ
1. 네 이 부분이 밑에 말씀드린 중화적정과 더불어 가장 중요한, 심화 문제 풀이에 있어서 핵심적인 아이디어가 되는 부분입니다.
우선 B-이온은 구경꾼 이온이지만 다른 이온반응의 구경꾼 이온과 다르다는 사실을 매우 유념하여야 합니다
그 이유는 HB의 경우 '약산'입니다.
약산은 처음에 이온화가 대부분 되어있지 않습니다. 예를 들면 HB 1몰 있을때 H+ B-는 0.1몰 있다고 해보죠
여기서 H+가 들어온 OH-와 이온화가 됩니다
그러면 H+는 사라지죠 (B- 0.1몰은 그대로 있어요)
이때 다시 HB가 0.1몰 만큼 이온화가 됩니다
원래 있던 B-와, 새로 이온화된 B-가 합쳐져서 0.2몰로 양이 늘어나게 됩니다.
이런 과정이 중화점까지 쭉 이어지게 되있어요
그럼 HB가 약산인것을 어떻게 아느냐?
위의 아이디어를 이해하고 외워두면
위의 그래프처럼 B-의 이온이 증가하는 그래프를 보고 약산이라고 결론을 내릴수있어요
반드시 이해하고 암기하셔야할 사항입니다.
반면에 HA는 강산입니다
왜냐하면 만약에 약산이라면 위의 과정을 겪을테고, 아니니까 강산입니다
즉 처음부터 모든 HA가 이온화되어있습니다.
2. 말씀하신 부분 이온화도= 이온화된 용질의 몰수/용질의 전체 몰수 은 맞는내용입니다.
여기에서 이온화된 용질의 몰수와 용질의 전체 몰수는 사고를 통해서 찾아내야 합니다
처음의 이온화된 용질의 몰수가 0.010 mol / 0.005 mol 임은 바로 알수있습니다.
조금 헷갈릴수가 있어요. 막 이렇게 저렇게 복잡하게 생각할수있거든요.
아직은 중화가 전혀 되지 않은 상태이기 때문에, 위의 그래프의 몰수 (이온화된 몰수)를 통해서 비교를 할수가 있습니다.
그럼 그때 '용질의 전체 몰수'는 어떻게 알 수 있을까요?
nMV = n'M'V' 공식을 보셨을 겁니다. 그것을 사용하셔서 구하시면 됩니다
밑의 문제에서 말씀드렸듯이 약산이라고 해도 지속적으로 이온화가 일어나기 때문에
전체 몰수를 비교할때 약산/강산에 상관없이 위의 공식을 사용할수 있습니다.
그러면 B의 경우 중화점까지 넣어준 NaOH의 부피가 20mL입니다
그러므로 1 * 20 = 1 * 20 이므로 B의 농도 (이온화/이온화 안된걸 포함한 전체 용질의 농도)는 1M이 됩니다.
전체 용질의 몰수를 구해야 하므로 농도 x 부피 = 1 * 0.02 = 0.02 mol 입니다.
여기에서 A의 경우는 조금 다릅니다. 위의 그래프로는 중화점을 찾을수가 없어요
그러면 좀더 생각을 해봐야 합니다
A는 강산이므로 처음에 모든 용질이 이온화가 됩니다
그러므로 처음의 용질 몰수는 0.01 mol 입니다.
A의 이온화도 0.01/0.01 = 1 입니다 (강산이므로)
B의 이온화도 0.005/0.02 = 0.25 입니다
그러므로 이온화도의 비는 4 : 1 입니다.
이온화도 = 이온화된 용질의 몰수/ 용질의 전체 몰수 에서요~
분자의 이온화된 용질의 몰수는 맨처음 NaOH를 넣지 않은 상태에서의 몰수를 말하는 건가요?
그렇다면 이온화도를 구할때 B- 이온의 몰수가 맨 처음엔 0.005 였다가 중화점에서 0.02 이므로 0.005/0.02 이렇게 구해도 되는건가요?
네 결과적으로 보면 맞다고 해야 겠네요
B-이온이 중화점에 이르면 다 이온화가 되고,
H가 1가 산이므로 HB 한분자당 B-이온이 1개 나오므로 그렇게 구해도 됩니다.
2가 산일 경우에는 다르게 해야겠지요